La caractérisation précise des tissus adipeux internes et sous-cutanés est devenue une question importante compte tenu de leurs contributions différentielles aux maladies métaboliques telles que le diabète. Pour étudier et comparer les effets des traitements antidiabétiques nous avons proposé de réaliser cette étude par imagerie et spectroscopie par résonance magnétique nucléaire. L’exemple concerne ici deux traitements antidiabétiques, l’un à partir d’un agent agoniste des PPARγ, la [Pioglitazone], l’autre d’un agent agoniste à la fois des PPARγ et PPARα, le [LM4156].
L’imagerie renseigne sur la quantité et la répartition des masses adipeuses (modèle animal). Trente rats obèses mâles de type Zucker (fa/fa), âgés de 10 semaines au début du traitement et répartis en trois groupes, ont été traités pendant 15 jours respectivement avec de la méthyl cellulose à 0,5 % (groupe placebo), avec un agoniste du PPAR, la Pioglitazone, à 30mg/kg/jour ou avec un double agoniste des PPAR + (LM 4156) à 100 mg/kg/jour. L’étude RMN a été réalisée au 15ème jour du traitement sur le système 2 teslas. L’acquisition de spectres eau-graisse RMN a été effectuée. Des images en coupes coronales et axiales pondérées en T1 ont été acquises par une séquence d’écho de spins (TR/TE= 480/15 ms, 4 accumulations, matrice =256 256, épaisseur de coupe de 3 mm pour un pixel de 254 254 m2). Les animaux ont été sacrifiés pour prélever les territoires adipeux étudiés et des pesées post mortem ont été effectuées afin de valider cette étude.
L’imagerie renseigne sur la quantité et la répartition des masses adipeuses (modèle animal). Trente rats obèses mâles de type Zucker (fa/fa), âgés de 10 semaines au début du traitement et répartis en trois groupes, ont été traités pendant 15 jours respectivement avec de la méthyl cellulose à 0,5 % (groupe placebo), avec un agoniste du PPAR, la Pioglitazone, à 30mg/kg/jour ou avec un double agoniste des PPAR + (LM 4156) à 100 mg/kg/jour. L’étude RMN a été réalisée au 15ème jour du traitement sur le système 2 teslas. L’acquisition de spectres eau-graisse RMN a été effectuée. Des images en coupes coronales et axiales pondérées en T1 ont été acquises par une séquence d’écho de spins (TR/TE= 480/15 ms, 4 accumulations, matrice =256 256, épaisseur de coupe de 3 mm pour un pixel de 254 254 m2). Les animaux ont été sacrifiés pour prélever les territoires adipeux étudiés et des pesées post mortem ont été effectuées afin de valider cette étude.
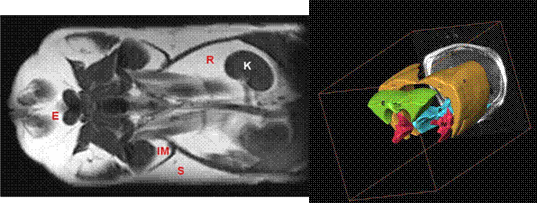
Coupe coronale d'un rat Zucker fa/fa (à gauche) et reconstruction 3D des territoires adipeux (à droite) par IRM
Nous montrons que l’imagerie RMN permet une quantification non invasive de la distribution des tissus adipeux chez le modèle animal étudié. Le protocole utilisé a été validé par une comparaison avec des mesures post mortem des territoires adipeux. Les effets d’un simple agoniste PPAR et d’un double agoniste PPARα+ sur l’accumulation de certains territoires adipeux chez le rat Zucker ont été mis en évidence, à savoir :
- la pioglitazone induit une augmentation significative des territoires adipeux étudiés à l’exception des graisses sous-cutanées qui ne sont pas affectées par ce traitement,
- le nouvel agent (LM4156) ne provoque pas d’effet significatif sur tous les territoires adipeux explorés [FISS-06a].
La spectroscopie renseigne sur le caractère intra ou extra –cellulaire des lipides (modèle animaux rats et souris). Le niveau des lipides musculaires est bien corrélé avec l’insulino-résistance et il peut être affecté par le régime alimentaire et par l’exercice musculaire. Ces lipides musculaires sont stockés sous forme de lipides intra-myocytaires (LIMC) ou extra-myocytaires (LEMC). Les LIMC sont stockés sous forme de petites gouttelettes lipidiques dans le sarcoplasme en apposition étroite aux mitochondries et réparties dans les fibres musculaires. Les LEMC, qui se trouvent entre les fibres musculaires avec une distribution spatiale peu homogène, participent peu au métabolisme et peuvent servir de réserves à long terme. Les techniques histologiques permettent de différencier les deux types de lipides mais toute quantification précise est difficilement réalisable. Cette quantification des lipides reste tout aussi délicate par les techniques biochimiques à cause de la dissection imparfaite des lipides adipocytaires placés entre les fibres musculaires, dissection qui contamine la quantification des LIMC.La spectroscopie RMN du proton est une méthode de choix pour étudier in vivo les deux types de lipides musculaires en se fondant sur la différence qui existe entre les susceptibilités magnétiques des gouttelettes lipidiques des myocytes et des dépôts de lipides stockés dans les adipocytes. Cette différence se traduit par un déplacement relatif des fréquences de résonance des protons de ces deux types de lipides. L’effet est maximal lorsque les fibres musculaires se trouvent parallèles à l’orientation du champ magnétique directeur B0 et sa valeur est égale dans ce cas à 0,2 ppm .
L’objectif de nos études spectroscopiques est de caractériser et de quantifier la composition lipidique à l’échelle cellulaire chez le rat Zucker qui est un bon modèle animal pour différents syndromes métaboliques. Les expériences ont été réalisées sur la plate forme « Animage » avec un système Bruker Biospec 7 teslas à aimant horizontal, en utilisant pour l’émission une antenne cage d’oiseau (diamètre intérieur de 72 mm) et pour la réception, une antenne de surface (diamètre de 15 mm). La patte postérieure du rat est positionnée sur l’antenne de surface de sorte que les fibres musculaires soient parallèles au champ magnétique statique pour avoir la meilleure séparation possible des LIMC et LEMC. La séquence de spectroscopie localisée utilisée est une PRESS précédée de motifs d’impulsion et de gradients permettant la suppression d’eau (VAPOR) et une meilleure sélection du volume d’intérêt (OSV).
Une caractérisation des temps de relaxation est en cours afin de faire une quantification et une correction des lipides en utilisant l’eau musculaire comme référence [FISS-06b]. Cette méthode de quantification des lipides musculaires chez le rat est délicate à appliquer à la souris. En effet, dans ce cas, les facteurs limitants sont la taille du muscle, l’orientation des fibres et la présence des graisses extracelulaires masquant dans la plupart du temps le faible pic des lipides intramyocytaires. L’acquisition du spectre proton au niveau du muscle squelettique de la souris nécessite un « shim » le plus parfait possible et une orientation la plus optimale possible (c’est à dire l’orientation des fibres parallèle à B0) pour obtenir une séparation entre les IMC et les EMC. Une étude, utilisant ce protocole, est en cours de réalisation, afin de caractériser et de suivre l’évolution des lipides intramyocytaires chez des souris témoins et transgéniques.
L’objectif de nos études spectroscopiques est de caractériser et de quantifier la composition lipidique à l’échelle cellulaire chez le rat Zucker qui est un bon modèle animal pour différents syndromes métaboliques. Les expériences ont été réalisées sur la plate forme « Animage » avec un système Bruker Biospec 7 teslas à aimant horizontal, en utilisant pour l’émission une antenne cage d’oiseau (diamètre intérieur de 72 mm) et pour la réception, une antenne de surface (diamètre de 15 mm). La patte postérieure du rat est positionnée sur l’antenne de surface de sorte que les fibres musculaires soient parallèles au champ magnétique statique pour avoir la meilleure séparation possible des LIMC et LEMC. La séquence de spectroscopie localisée utilisée est une PRESS précédée de motifs d’impulsion et de gradients permettant la suppression d’eau (VAPOR) et une meilleure sélection du volume d’intérêt (OSV).
Une caractérisation des temps de relaxation est en cours afin de faire une quantification et une correction des lipides en utilisant l’eau musculaire comme référence [FISS-06b]. Cette méthode de quantification des lipides musculaires chez le rat est délicate à appliquer à la souris. En effet, dans ce cas, les facteurs limitants sont la taille du muscle, l’orientation des fibres et la présence des graisses extracelulaires masquant dans la plupart du temps le faible pic des lipides intramyocytaires. L’acquisition du spectre proton au niveau du muscle squelettique de la souris nécessite un « shim » le plus parfait possible et une orientation la plus optimale possible (c’est à dire l’orientation des fibres parallèle à B0) pour obtenir une séparation entre les IMC et les EMC. Une étude, utilisant ce protocole, est en cours de réalisation, afin de caractériser et de suivre l’évolution des lipides intramyocytaires chez des souris témoins et transgéniques.
