Encadrement : - Aurélie Dutour, CRCL
- Pauline Muleki Seya, CREATIS
Contexte :
Le cancer est actuellement la principale cause de mortalité en France, et une détection précoce ainsi que de nouveaux traitements sont indispensables pour améliorer la survie des patients. Concernant la détection précoce, des tests sanguins (ex : cancer de la prostate) mais aussi des campagnes de dépistage (ex : cancer du sein) ont été mis en place. L’examen qui va permettre de caractériser une tumeur est la biopsie. Cette caractérisation est nécessaire pour la bonne prise en charge du patient, mais la biopsie est invasive, locale et demeure une source d’anxiété pour le patient. Il existe donc un besoin de développer de nouvelles techniques de caractérisation non invasives, globales et rapides du cancer, notamment par imagerie, afin de déterminer la classification histologique et le grade de la tumeur. Outre le diagnostic, l’évaluation de la nécrose après traitement type chimiothérapie est également fondamentale, car c’est, pour de nombreuses tumeurs comme les sarcomes, le critère de l’efficacité de ces agents. Une évaluation précoce par imagerie de l’induction de cette mort cellulaire permettrait de confirmer rapidement l’efficacité de la thérapie utilisée, ou de procéder à un changement en cas de tumeur non répondante, et ainsi de ne plus attendre l’évaluation de la réponse thérapeutique sur pièce chirurgicale, par exemple pour les sarcomes osseux.
Dans ce projet, nous proposons de nous intéresser à ces deux thématiques via l’imagerie ultrasonore, modalité non ionisante et très répandue, et plus précisément via deux techniques :
- La spectroscopie ultrasonore, qui permet de remonter à des informations sur la microstructure tissulaire par l’étude fréquentielle du coefficient de rétrodiffusion ultrasonore (BSC) [1]. Des grandeurs quantitatives ultrasonores sont ensuite évaluées soit directement à partir de ce coefficient de rétrodiffusion soit par une approche inverse en utilisant des modèles de diffusion ultrasonore et permettant d’estimer des paramètres des diffuseurs (rayon, paramètres acoustiques notamment).
- L’imagerie par localisation ultrasonore permet de remonter à des cartographies de la microvascularisation avec une résolution micrométrique et une profondeur d’imagerie centimétrique [2]. Cette technique est basée sur le principe de l’imagerie otique FPALM [3] et consiste à détecter des microbulles (agents de contraste ultrasonores) isolées dans le flux sanguin, puis à suivre leur déplacement durant des acquisitions ultrasonores ultra-rapides. L’accumulation des trajectoires des microbulles détectées permet de remonter à une cartographie de la microvascularisation très résolue ainsi qu’aux vitesses de flux dans les différents vaisseaux.
Ces deux techniques ultrasonores, complémentaires, permettent d’avoir des informations sur la microstructure tissulaire et sur sa vascularisation et peuvent donc permettre l’extraction de paramètres pertinents pour l’étude du cancer, à la fois pour le diagnostic et le suivi thérapeutique.
En effet, les tumeurs présentent des différences avec les tissus sains et entre elles : des différences de propriétés mécaniques à l’échelle cellulaire/tissulaire, des différences morphologiques (présence d’acini, densité vasculaire, présence ou non de matrice), et structurelles (répartition plus compacte et désordonnée des cellules) [4]. Les tumeurs bénignes et malignes ont des caractéristiques physiques différentes. Les tumeurs malignes, contrairement aux tumeurs bénignes, ne sont pas bien définies dans l'espace, présentent des différences avec les tissus sains environnants, sont hétérogènes et sont composées de cellules plus irrégulières. Ainsi, dans une étude en spectroscopie ultrasonore, l’évaluation de paramètres des diffuseurs a permis de montrer que la technique pouvait différencier une tumeur bénigne (fibroadénome mammaire chez le rat) d’une tumeur maligne (carcinome 4T1 chez la souris) [5]. Nous avons également pu récemment montrer que cette technique permettait de différentier deux types de sarcomes osseux malins [6]. Les tumeurs vont également présenter une vascularisation différente des tissus sains avec la présence de vaisseaux anormaux, irrégulièrement anastomosés et distribués dans la tumeur. L’imagerie par localisation ultrasonore a pu mettre en avant des différences, notamment en termes de tortuosité entre une tumeur et le tissu sain environnant sur des fibrosarcomes sous-cutanés [7]. Entre elles, les tumeurs ne vont également pas présenter la même vascularisation, certaines étant peu vascularisées alors que d’autres sont très vascularisées, ce qui a été observé par imagerie ultrasonore sur trois types de tumeurs (carcinomes épidermoïde, pulmonaire non à petites cellules et ovarien) implantées en xénogreffes chez la souris [8].
Sur le plan thérapeutique, les traitements conventionnels (chimiothérapie, radiothérapie) vont induire notamment de la nécrose, et il est important de pouvoir évaluer le taux de nécrose de la tumeur afin de déterminer rapidement si la tumeur répond ou non à un traitement, et ajuster/changer si besoin le traitement. La mort cellulaire s'accompagne de changements morphologiques et le suivi des paramètres liés à la microstructure tissulaire et évalués par spectroscopie ultrasonore a pu fournir des informations précoces sur les effets du traitement anti-cancer. C’est notamment le cas pour la mort par apoptose [9] dans une étude sur des cellules de leucémie myéloïde traitées à la cisplatine pendant quelques heures (4 à 48h) ou par catastrophe mitotique [10] pour des cellules de leucémie myéloïde et des lignées cellulaires de cancer de la tête et du cou Hep-2 et FaDu, traitées à la radiothérapie. Enfin, un autre type de traitement qui entraine des changements morphologiques et structurels de la tumeur sont les traitements anti-angiogéniques. Ces agents ont pour but de restaurer une vascularisation moins anarchique et vont donc également induire des changements de la microvascularisation de la tumeur. Une étude préliminaire a ainsi montré une diminution de la vascularisation dans les cartographies de la microstructure vasculaire 2h après injection de bevacizumab en imagerie par localisation ultrasonore [11].
Il semble donc pertinent d’étudier l’utilisation conjointe de la spectroscopie et de l’imagerie par localisation ultrasonore pour l’aide au diagnostic et au suivi de thérapie. Dans le cadre de cette thèse, des modèles de sarcomes musculosquelettiques (chondrosarcomes, ostéosarcomes, rhabdomyosarcomes) seront utilisés. Bien qu’une partie de ces sarcomes soient des tumeurs osseuses, celles-ci poussent principalement sur l’os dans ces modèles ; il n’y aura donc aucune difficulté à les imager par ultrasons. Ces modèles sont maîtrisés et présentent les principales caractéristiques des sarcomes musculosquellettiques chez l’homme. Ils sont particulièrement adaptés pour l'étude envisagée car ces sous-types tumoraux présentent des caractéristiques différentes en termes de cellularité, de prolifération, de composition de la matrice extracellulaire et de vascularisation. Toutefois ces tumeurs ont des caractéristiques communes : elles sont résistantes aux thérapies conventionnelles, ont des taux de survie qui stagnent, et enfin nécessitent de savoir rapidement si le patient répond ou non pour réorienter la thérapie. Actuellement, la réponse (ou non réponse) d’une tumeur à un traitement comme une polychimiothérapie se fait sur pièce opératoire, au moment de la résection chirurgicale de la tumeur, i.e. à la fin du cycle de traitement. Soit après plusieurs semaines de chimiothérapie.
Ce projet a été initié début 2021 par la collaboration entre nos deux laboratoires, le CRCL et CREATIS, et facilité par un financement du CNRS (PEPS) puis du Cancéropôle. Des résultats préliminaires ont ainsi pu être obtenus lors de ces projets. Dans le projet du Cancéropôle CAMUT, des acquisitions de spectroscopie ultrasonore sur des modèles d’ostéosarcome et de chondrosarcome traités ou non avec la chimiothérapie conventionnelle ont été réalisées. Ces dernières seront évaluées par comparaison avec les coupes histologiques correspondantes.
Résultats préliminaires :
Il a été observé que le coefficient de rétrodiffusion (BSC pour Backscatter coefficient) des chondrosarcomes (Ch1 à Ch5) est différent et présente notamment une amplitude plus élevée que ceux des ostéosarcomes (Figure 1(a)). Sur les images histologiques, les noyaux et cellules des chondrosarcomes sont plus gros que ceux des ostéosarcomes (Figure 1(b-c)). Les coefficients de rétrodiffusion des ostéosarcomes Os1 et Os2 sont différents des coefficients de rétrodiffusion des ostéosarcomes Os3 et Os4. Ceux-ci proviennent de deux lignées cellulaires différentes (lignée murine K7M2, MOS-J) et l’étalement du rayon des noyaux a été trouvé légèrement différent entre ces deux lignées sur les images histologiques [12].
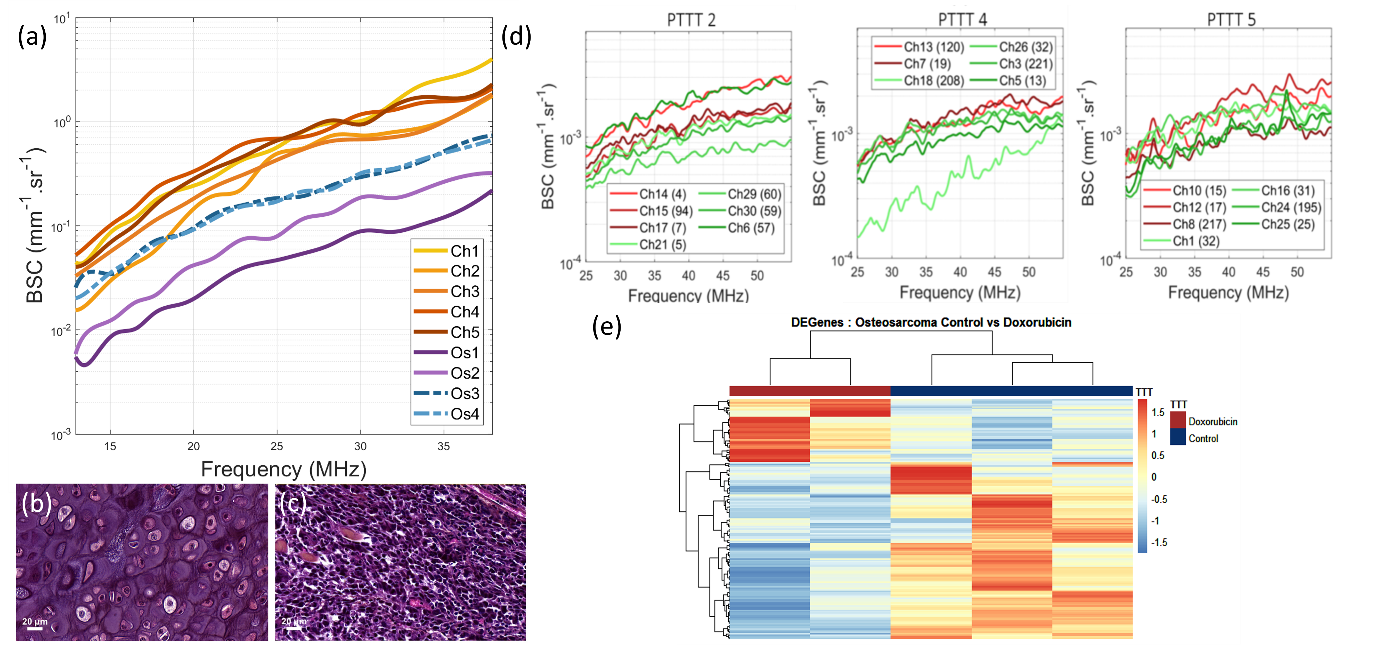
Figure 1 : (a) Coefficients de rétrodiffusion moyens pour les tumeurs de chondrosarcomes (Ch1 à Ch5) et d’ostéosarcomes (Os1-2 et Os3-4 proviennent des lignées cellulaires K7M2 et MOS-J). Exemple d’images histologiques de (b) chondrosarcome et (c) d’ostéosarcome. (d) Coefficients de rétrodiffusion moyens pour les tumeurs d’ostéosarcomes (contrôles en rouge et traités en vert) après 2, 4 ou 5 traitements. (e) Analyse RNA Seq (2 ostéosarcomes traités et 3 ostéosarcomes contrôles). Les gènes surexprimés par les ostéosarcomes traités par rapport aux contrôles apparaissent en coloration rouge et ceux sous exprimés en bleu.
Concernant les tumeurs traitées à la chimiothérapie, nous avons pu observer que les coefficients de rétrodiffusion des tumeurs traitées présentaient des différences avec les tumeurs contrôles après 2 et 4 traitements mais pas 5 (cas des ostéosarcomes Figure 1(d)). Ce comportement du BSC pourrait refléter le mécanisme de chimiorésistance. Des différences dans l’expression de gènes des tumeurs traitées ont été observées sur des analyses RNASeq préliminaires (Figure 1(e)) notamment sur l’expression des gènes liés au collagène, à la condensation de la chromatine et à la chimiorésistance.
Ces résultats très prometteurs montrent que l’imagerie ultrasonore permet de discerner des sous types histologiques des tumeurs de façon non-invasive, et également de noter des changements biologiques qui surviennent au cours de traitement
Objectifs et plan de thèse :
Ce projet a pour but : (1) d’explorer les paramètres ultrasonores (liés aux microstructures tissulaire et vasculaire) permettant de caractériser des tumeurs et appliqué aux cas des sarcomes musculosquelettiques, et (2) d’analyser la pertinence de ces paramètres ultrasonores pour l’évaluation de l’efficacité d’une thérapie anti-cancer (chimiothérapie conventionnelle et thérapie anti-angiogénique) par l’apparition notamment de nécrose et remaniement de la structure vasculaire. On s’intéressera tout particulièrement à comprendre l’origine des différences des paramètres ultrasonores entre ces types de tumeurs, et après traitement anti-cancer notamment, par la composition du tissu après analyse histologique (quantification de la nécrose, analyse de la vascularisation…) et analyse transcriptomique (RNASeq pour voir si les paramètres ultrasonores reflètent des modifications au niveau de la cellule tumorale). Ce projet de thèse est divisé en trois tâches principales :
Tâche 1 : Développements méthodologiques
Les méthodes de spectroscopie ultrasonore et d’imagerie par localisation ultrasonore seront étudiées dans l’équipe de CREATIS (Pauline Muleki Seya, équipe Imagerie Ultrasonore). En effet, des mesures de spectroscopie ultrasonore ont pour l’instant seulement été réalisées ex vivo à CREATIS. Pour son utilisation sur le petit animal anesthésié ne devrait pas engendrer d’importantes difficultés. Des algorithmes de mesures de l’atténuation différents devront être implémentés à partir de la littérature et différentes stratégies pour une correction optimale permettant de remonter au BSC correcte devront être testées. De même, un dispositif expérimental pour les mesures d’imagerie par localisation ultrasonore sur petit animal est en cours de mise en place sur la plateforme d’imagerie du laboratoire. Il faudra tout particulièrement s’intéresser à la correction de mouvement pour recaler les images ultrasonores. Les algorithmes classiques de l’imagerie par localisation ultrasonore [13] seront utilisés mais des amélioration sur la formation des images et la détection des microbulles et notamment des microbulles les plus lentes pourront être implémentées. Ces mesures seront réalisées sur la plateforme d’imagerie PILoT sur un échographe programmable Verasonics avec une sonde matricielle à 8 MHz permettant d’imager en 3D la tumeur. Afin d’avoir des mesures avec une meilleure résolution, des sondes linéaires (permettant des acquisitions 2D) mais à plus hautes fréquences (centrées sur 15 et 25 MHz) seront également utilisées pour cette étude.
Tâche 2 : Caractérisation de tumeurs par ultrasons
Pour la caractérisation des modèles de sarcomes osseux, des acquisitions ultrasonores in vivo seront réalisées sur les tumeurs de sarcomes musculosquelettiques établies et en croissance à différents moments de leur progression (4 points seront effectués correspondant à l'initiation de la croissance tumorale, à la phase de prolifération de la tumeur (2 points prévus) et lorsque la tumeur atteint son point limite et présente des zones de nécrose en son centre, 4 à 5 animaux par points de mesures). Après les mesures ultrasonores, les animaux seront euthanasiés et les échantillons tumoraux seront conservés pour étude histologique (caractérisation de la structure tumorale (HPS), de la matrice extracellulaire (collagenes I et III), de la densité vasculaire (CD31)) et transcriptomique (RNAseq Bulk) Les paramètres issus de la spectroscopie ultrasonore (BSC moyen, paramètres directs et paramètres des diffuseurs pour différents modèles) seront mesurés. Les différences des paramètres issus de la spectroscopie ultrasonore pour les différentes tumeurs/temps de pousse seront comparées aux images histologiques et notamment la présence de nécrose et la quantité de collagènes. Les cartographies de la microstructure vasculaire des différents modèles seront évaluées et à partir de celles-ci, des caractéristiques des tumeurs seront définies (volume de la vascularisation, tortuosité des vaisseaux, vitesse du flux…) et comparés aux analyses histologiques. Le potentiel de ces paramètres ultrasonores, seuls ou en combinaison par un arbre de décision, pour la caractérisation de ces tumeurs sera évalué.
Tâche 3 : Evaluation de l’effet de la thérapie anti-cancer par ultrasons
La troisième étape de ce projet validera la possibilité d'utiliser des paramètres ultrasonores issus de la spectroscopie ultrasonore et de l’imagerie par localisation ultrasonore pour suivre la réponse tumorale au traitement, et identifier les changements précoces dus à la nécrose par exemple à la nécrose. Cette étude sera réalisée sur des tumeurs de sarcomes musculosquelettiques établies et traitées par la doxorubicine, une chimiothérapie conventionnellement utilisée dans le traitement des sarcomes et une thérapie anti-angiogénique. Préalablement à cette étude nous aurons dans un premier temps déterminé la dose de traitement anti-angiogénique optimale. Pour cette étude cinétique, les animaux seront répartis en 3 groupes : contrôles, doxorubicine et traitement anti-angiogénique (4 à 5 animaux par points de mesures). Comme dans la Tâche 2, des acquisitions ultrasonores séquentielles et des analyses histologiques des structures tumorales seront effectuées. L'imagerie ultrasonore sera réalisée séquentiellement au cours de l'étude (au diagnostic de la tumeur J0, et 24 heures après la 3ème, 4ème, 5ème et/ou dernière administration de thérapie) in vivo. Des analyses histologiques similaires seront effectuées comme dans la tâche 2. Le pourcentage de nécrose et les paramètres de rayon et concentration des structures cellulaires seront évalués sur les coupes histologiques et comparé aux paramètres ultrasonores. Les changements de la cartographie vasculaire dus à la thérapie seront mis en avant et comparés aux analyses histologiques de la vascularisation. On s’intéressera tout particulièrement à comprendre les mécanismes biologiques/morphologiques liés aux paramètres ultrasonores et notamment par des analyses RNA Seq sur animaux contrôles, traités répondeurs et non répondeurs pour déterminer ce que les changements dans mesures du BSC traduisent au niveau cellulaire.
Financement de la thèse
Le sujet sera soumis à l’appel à thèse de la Ligue Contre le Cancer (deadline 24/06/2024) qui s’appuie à la fois sur le sujet et le candidat pour attribuer les financements (sur dossier uniquement).
Déroulement de la thèse et profil du candidat recherché
Cette thèse sera réalisée entre les laboratoires CREATIS dans l’équipe Imagerie Ultrasonore (Villeurbanne) et CRCL équipe Mort cellulaire et Cancers pédiatriques et sera encadrée par Pauline Muleki Seya et Aurélie Dutour.
Le candidat aura idéalement une formation d'ingénieur, ou équivalent, avec une spécialisation en imagerie biomédicale et/ou ultrasons et/ou traitement du signal. Le candidat devra être autonome et avoir des connaissances en programmation Matlab et en traitement du signal/des images. Le candidat sera amené à faire des acquisitions en expérimentation animales. Le candidat devra également avoir un intérêt pour les applications médicales/biologiques.
Candidature
Envoyer votre CV, lettre de motivation et relevés de notes (M1 et M2) à pauline.muleki-seya@creatis.insa-lyon.fr.
Bibliographie
[1] Oelze ML, Mamou J. Review of Quantitative Ultrasound: Envelope Statistics and Backscatter Coefficient Imaging and Contributions to Diagnostic Ultrasound. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control 2016;63:336–51. https://doi.org/10.1109/TUFFC.2015.2513958.
[2] Couture O, Hingot V, Heiles B, Muleki-Seya P, Tanter M. Ultrasound Localization Microscopy and Super-Resolution: A State of the Art. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control 2018;65:1304–20. https://doi.org/10.1109/TUFFC.2018.2850811.
[3] Betzig E, Patterson GH, Sougrat R, Lindwasser OW, Olenych S, Bonifacino JS, et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science 2006;313:1642–5. https://doi.org/10.1126/science.1127344.
[4] Lee GYH, Lim CT. Biomechanics approaches to studying human diseases. Trends in Biotechnology 2007;25:111–8. https://doi.org/10.1016/j.tibtech.2007.01.005.
[5] Oelze ML, O’Brien WD, Blue JP, Zachary JF. Differentiation and characterization of rat mammary fibroadenomas and 4T1 mouse carcinomas using quantitative ultrasound imaging. IEEE Transactions on Medical Imaging 2004;23:764–71. https://doi.org/10.1109/TMI.2004.826953.
[6] Malinet C, Muleki-Seya P, Dutour A, Fajnorova I, Liebgott H, Montcel B. Toward cancer characterization using light backscattering spectroscopy and quantitative ultrasound. Photons Plus Ultrasound: Imaging and Sensing 2023, vol. 12379, SPIE; 2023, p. 39–46. https://doi.org/10.1117/12.2648087.
[7] Lin F, Shelton SE, Espíndola D, Rojas JD, Pinton G, Dayton PA. 3-D Ultrasound Localization Microscopy for Identifying Microvascular Morphology Features of Tumor Angiogenesis at a Resolution Beyond the Diffraction Limit of Conventional Ultrasound. Theranostics 2017;7:196–204. https://doi.org/10.7150/thno.16899.
[8] Opacic T, Dencks S, Theek B, Piepenbrock M, Ackermann D, Rix A, et al. Motion model ultrasound localization microscopy for preclinical and clinical multiparametric tumor characterization. Nat Commun 2018;9:1527. https://doi.org/10.1038/s41467-018-03973-8.
[9] Kolios MC, Czarnota GJ, Lee M, Hunt JW, Sherar MD. Ultrasonic spectral parameter characterization of apoptosis. Ultrasound in Medicine & Biology 2002;28:589–97. https://doi.org/10.1016/S0301-5629(02)00492-1.
[10] Vlad RM, Alajez NM, Giles A, Kolios MC, Czarnota GJ. Quantitative Ultrasound Characterization of Cancer Radiotherapy Effects In Vitro. International Journal of Radiation Oncology*Biology*Physics 2008;72:1236–43. https://doi.org/10.1016/j.ijrobp.2008.07.027.
[11] Ghosh D, Xiong F, Sirsi SR, Mattrey R, Brekken R, Kim J-W, et al. Monitoring early tumor response to vascular targeted therapy using super-resolution ultrasound imaging. 2017 IEEE International Ultrasonics Symposium (IUS), 2017, p. 1–4. https://doi.org/10.1109/ULTSYM.2017.8092944.
[12] Malinet C, Montcel B, Dutour A, Fajnorova I, Liebgott H, Muleki-Seya P. Cancer characterization using light backscattering spectroscopy and quantitative ultrasound: an ex vivo study on sarcoma subtypes. Sci Rep 2023;13:16650. https://doi.org/10.1038/s41598-023-43322-4.
[13] Heiles B, Chavignon A, Hingot V, Lopez P, Teston E, Couture O. Performance benchmarking of microbubble-localization algorithms for ultrasound localization microscopy. Nat Biomed Eng 2022;6:605–16. https://doi.org/10.1038/s41551-021-00824-8.
